Tout savoir sur la traçabilité pharmaceutique et ses enjeux
Imaginez un monde où vous pouvez avoir pleine confiance en chaque médicament, où les risques sont minimisés et où la supply-chain pharmaceutique est sécurisée à chaque étape.
La traçabilité pharmaceutique est la clé de cette réalité, offrant des garanties d’authenticité et de sécurité sans compromis. Dans les lignes qui suivent, plongez dans les enjeux de la traçabilité pharmaceutique et découvrez comment elle protège les patients et renforce la confiance des professionnels de santé.


Qu'est-ce que la traçabilité ?
La traçabilité est un concept appliqué à de nombreux domaines comme notamment les industriels, l’agroalimentaire ou encore les déchets.
De manière générale, il se résume à suivre l’historique d’un objet ou un produit durant tout son parcours de vie. Aujourd’hui, ce procédé est essentiel car il permet de connaître toutes les informations liées à un produit et d’éviter les risques pour les consommateurs.
Le cas de la traçabilité pharmaceutique
Dans le cadre de l’industrie pharmaceutique, les professionnels de santé ont pour mission de développer, concevoir et fabriquer des médicaments. Ils ont également la responsabilité de garantir la sécurité et l’intégrité des produits qui seront délivrés aux consommateurs.
Dans ces conditions, la traçabilité pharmaceutique est donc un besoin fondamental pour les professionnels comme pour les consommateurs. Elle permet de répondre à plusieurs objectifs :
- Certifier l’intégrité du produit de santé.
- Faciliter le retrait d’une mauvaise série de médicament en cas de problème.
- Garantir l’historique des médicaments à chaque étape.
- Garantir que le médicament est certifié et non contrefait.
- Éviter les risques sanitaires pour le patient.
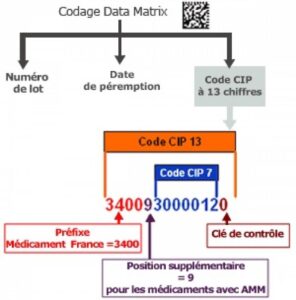
Pour sécuriser la traçabilité des produits de santé, un système de codification a été mis en place. Ce système repose sur 2 codes présents sur chaque produit de santé. D’un côté, le code « Datamatrix » qui a remplacé le code-barre standard et de l’autre, le code « CIP » (Code Identifiant de Présentation).
Source image : ANSM
Comme le précise l’ANSM, le code CIP est composé de 13 chiffres. Il englobe « la dénomination, la forme pharmaceutique, le dosage, le conditionnement et la contenance de son conditionnement » mais aussi le numéro de lot et la date de péremption. Un processus nécessaire pour renforcer l’identification des produits de santé et pour garder en permanence un historique de leurs parcours.
Pourquoi la traçabilité des médicaments et des vaccins est-elle importante ?
Au-delà des enjeux cités précédemment, la traçabilité pharmaceutique permet aussi de lutter contre le trafic de médicaments falsifiés ou de vaccins. Depuis une vingtaine d’années et particulièrement durant le COVID, la commercialisation de produits de santé contrefaits a connu une forte croissance, notamment en Europe.
Ce phénomène de santé publique est particulièrement dangereux pour les personnes qui consomment des produits contrefaits. Ces derniers prennent des risques considérables dus notamment :
- Aux conditions de conservation non respectées
- A la mauvaise quantité de la substance active du produit
- A la présence de substances toxiques
- A une date de péremption dépassée
Dans le cadre de la lutte contre ce phénomène, Interpol a mis en ligne une liste de règles à consulter en cas de doute sur l’intégrité du médicament.
Par ailleurs, les autorités compétentes ont également mis en place un dispositif de sérialisation des médicaments pour les fabricants et les pharmaciens en officine. Celui-ci permet de renforcer la sécurisation de la traçabilité pharmaceutique grâce :
- A l’identification unique (Code Datamatrix et CIP évoqués précédemment)
- Au dispositif d’inviolabilité posés par le fabricant puis vérifié par le pharmacien.
Quels sont les deux types de traçabilité ?
Afin d’assurer la sécurité de la chaîne du médicament, il existe deux types de traçabilité à respecter :
- Une traçabilité en amont avec les BPF (Bonnes Pratiques de Fabrication)
- Une traçabilité en aval avec les BPD (Bonnes Pratiques de Distribution)
Les BPF posent un cadre pour les professionnels de l’industrie pharmaceutique, cosmétique et agroalimentaire. Pour chaque lot, les fabricants doivent renseigner des indications précises (spécificités, méthode de conservation et température à respecter, de fabrication, composants…). En respectant ces instructions, ils peuvent se porter garants de la qualité des produits fabriqués et retracer facilement son historique.
Les BPD assurent la continuité des BPF. Elles sont composées d’un ensemble d’instructions et de réglementations qui encadrent la distribution des médicaments. Ces normes permettent d’assurer la sécurité et la traçabilité de ces produits de santé tout au long de leur distribution jusqu’au consommateur.
Règlementation et législation de la traçabilité pharmaceutique en 2023
Pour sécuriser les dispositifs évoqués précédemment, les autorités ont mis en place des lois qui assurent la traçabilité des produits pharmaceutiques.
Code de la santé publique : Articles R5112-1 à R5161-1 et traçabilité
En France, le code de la santé publique prévoit dans sa cinquième partie, un ensemble de lois applicables aux produits de santé et à leur traçabilité. Parmi celles-ci, on retiendra notamment les articles R5112-1 à R5161-1 qui régissent les produits pharmaceutiques.
Voici la liste des principaux articles de cette section relatifs à la traçabilité :
- Articles R5121-16 et R5121-201-6 relatifs aux bonnes pratiques de l’étiquetage des produits et à sa traçabilité.
- Article R5121-146-2 qui régit la traçabilité du numéro de lot.
- Article R5121-183 qui encadre la traçabilité des médicaments dérivés du sang et R5121-201-2 pour l’encadrement des médicaments en général.
- Articles R5121-201-4 et R5121-201-5 pour la traçabilité des médicaments de thérapie innovante préparés ponctuellement.
- Article R5124-49-1 pour apporter des précisions sur la traçabilité lors de la fabrication et l’importation.
- Article D5125-45-1 qui prévoit dans son texte une partie sur la traçabilité dans la « délivrance, livraison, dispensation à domicile des médicaments ».
Si vous souhaitez en savoir plus sur le droit en vigueur des produits pharmaceutiques, vous pouvez consulter l’ensemble des lois sur le site du gouvernement Légifrance.
Les directives européennes
En Europe, des directives sont également instaurées pour protéger les consommateurs et les professionnels de santé :
- La directive 2001/83/CE garantit la sécurité « des médicaments à usage humain après leur mise sur le marché » notamment à travers un document obligatoire fourni par le grossiste qui présente un ensemble de données permettant de facilité la traçabilité et l’identification du produit.
- La directive 2003/94/CE précise les bonnes pratiques et la documentation à fournir pour assurer la traçabilité des médicaments lors de leur fabrication.
- La directive 2011/62 est spécifique à l’authenticité et à la traçabilité des médicaments pour lutter contre le trafic de médicaments contrefaits.
Quels sont les risques encourus pour un non-respect de la traçabilité ?
En cas de non-respect de la traçabilité pharmaceutique, les personnes commettant des infractions seront sanctionnées par les autorités compétentes.
Voici une liste non exhaustive des sanctions possibles :
- La saisie des produits concernés
- La fermeture du lieu où l’infraction a été constatée et vérifiée
- Une amende pouvant atteindre des centaines de milliers d’euros
- Une peine d’emprisonnement
Vous pouvez retrouver l’ensemble des peines prescrites par la loi sur le site du gouvernement Légifrance.
Table des matières
Automatisez votre suivi de température avec un système fiable et conforme aux normes du secteur de la santé.
Je découvre